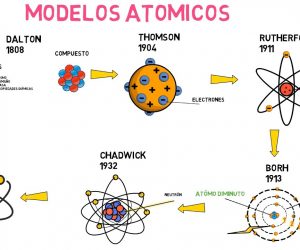
 Existen diversos modelos o teorías atómicas que se han creado con la intención de comprender de mejor manera todo lo relacionado al átomo. Cada modelo se descubrió en una época distinta y con el paso del tiempo los equipos nuevos permiten estudiar el átomo de mejor forma. Estos modelos han cambiado hasta los tiempos actuales.
Existen diversos modelos o teorías atómicas que se han creado con la intención de comprender de mejor manera todo lo relacionado al átomo. Cada modelo se descubrió en una época distinta y con el paso del tiempo los equipos nuevos permiten estudiar el átomo de mejor forma. Estos modelos han cambiado hasta los tiempos actuales.
Cuando la materia se divide, se encuentra una parte que no puede seguirse dividiendo, a esta se le llama átomo. Muchos expertos han buscado la mejor forma de explicar el átomo, de esto surgen los conocidos actualmente como modelos atómicos.
Características del Modelo Atómico
Existen muchos modelos atómicos, algunas de las características de los más importantes son:
Modelo atómico de Demócrito
En este modelo atómico, sus teorías filosóficas sirven de base para sus descubrimientos. Se utilizaron para elaborar la teoría atómica del universo en el 450 antes de Cristo.
- La materia posee propiedades que pueden cambiar de acuerdo a la forma en que se agrupan los átomos.
- Todo átomo es homogéneo, eterno, incomprensible e indivisible.
- Las diferencias entre los átomos solo son de tamaño y forma pero no por cualidades interiores.
Modelo atómico de Dalton
El científico y meteorólogo John Dalton ofreció por primera vez un modelo atómico que se basó en la ciencia, a esto se le llama teoría atómica. Este modelo mantuvo su vigencia alrededor de un siglo, presentando esferas de madera con distintos tamaños que representaban los múltiples elementos.
El protón y el electrón no habían sido descubiertos para ese entonces.
- Los átomos que forman parte de un mismo elemento son iguales entre ellos. Esto inició el concepto del relativo peso atómico.
- La parte más pequeña de la materia son los átomos. Son indestructibles e indivisibles.
- Cuando se combinan los átomos y crean los compuestos, mantienen las relaciones simples de números enteros y pequeños de igual forma.
- Cuando se combinan o se exponen a reacciones químicas, siguen siendo indivisibles.
- Cuando se combinan o se unen átomos de dos o más elementos, se crean los compuestos químicos.
- Es posible crear más de un compuesto al combinar átomos de distintos elementos.
Modelo atómico de Thomson
Fue desarrollado por Joseph John Thomson, quien anteriormente había descubierto el electrón. Este modelo atómico dice que los electrones se incrustan a la masa del átomo teniendo carga positiva. Los estudios realizados en ese entonces demostraron que los rayos catódicos eran corriente realizada con partículas de carga negativa.
- La apariencia de los átomos es esférica, su radio corresponde a 0,00000001 cm.
- Toda la carga de un átomo neutro es igual a cero.
- Los protones y electrones tienen la misma carga pero acompañados de signos opuestos.
Modelo atómico de Rutherford
El físico Ernest Rutherford solucionó el problema de la estructura atómica en el 1911. Después de descubrir la radiactividad Rutherford junto a otros estudiantes, llegaron a bombardear algunos elementos químicos y al mismo tiempo realizar el cálculo del ángulo de dispersión de las partículas. Si el átomo era redondo, esto significaba que las partículas solo tendrían una desviación mínima. Pero al realizar las respectivas pruebas se dieron cuenta de que un grupo de partículas rebotaba por el núcleo pequeño, condensado y denso.
- Los protones están agrupados en el mismo centro del núcleo y los electrones se distribuyen de forma descuidada.
- La masa de los neutrones y protones es similar a la del átomo mismo.
- El núcleo del átomo tiene carga positiva y es denso.
Modelo atómico de Bohr
En este modelo atómico se explica que los electrones tienen energía y se resolvió el fenómeno de los espectros al absorber un elemento. Para obtener estas conclusiones, Bohr utilizó las enseñanzas de Einstein y Planck.
- El movimiento de los electrones sigue una ruta circular llamada nivel o capa energética.
- El movimiento de los electrones es estable con algún nivel de distancia y energía provenientes del mismo átomo.
- Las capas se llaman con las letras K, L, M, N y así sucesivamente.
- Si el electrón se encuentra en estado estacionario, no puede generar fotón o luz.
Modelo atómico de Schrödinger
Los anteriores estudios permitieron el origen de este nuevo modelo que acepta los electrones como ondulaciones de la materia. Esto generó la formulación que luego expuso las probabilidades de la función de onda.
Esto se interpreta como la posibilidad de estudiar de manera probabilística la cantidad o posición de movimiento que un electrón tiene, pero no ambas cosas al mismo tiempo, debido a lo conocido como el principio de incertidumbre de Heisenberg. Actualmente este modelo está vigente y se llama Modelo Ondulatorio o Cuántico.
